با سلام، من ریموند رخشانی هستم و حوزه کارشناسی ارشد من مهندسی سیستم ها و اتوماسیون کارخانه است، و حوزه تخصص من بکارگیری اندیشه سیستمی برای انتقال فن آوری و اجرا و پیاده سازی تولید فرآورده های نوین[۱] میباشد.
در این سلسله از مقالات و فایل های صوتی[۲]، کوشش می کنم که علم نانو[۳] و فنآوری نانو[۴] را (به زبان فارسی) از پایه، بنحوی سیستماتیک به دوستانی که علاقمند هستند، در حد توان، ارائه کنم.
در واقع این مقالات، فصل های کتاب جدیدی با همین نام (سفر به ریزها) هستند که سالهاست بر روی آن کار می کنم و در دست تهیه است، و تصمیم گرفته ام که پیشاپیش آن را، فصل به فصل، بطوری مجازی منتشر کنم.
از پژوهشگران و اندیشمندان عزیز خواهشمندم که لینک ها را به دوستان و بویژه به جوانان دانش پژوه ما (که اغلب دسترسی نظام مند برای آشنایی با علم و فنآوری نانو – به زبان فارسی – ندارند) ارسال فرمایند. با احترام، ر. رخشانی
اهمیت بنیادین مقیاس نانو
در فصل دوم کتاب سفر به ریزها[۵] فرصت این را داریم تا به قوانین و قواعدی که بر دنیای مقیاس های نانویی حکومت می رانند[۶]، یعنی به اصولی فیزیکی و شیمیایی بپردازیم[۷]. همچنین شانس آن را خواهیم داشت تا با ذراتی که بخش های سازنده دنیای نانو[۸] هستند، یعنی با اتم ها و ملکول هایی که مواد را می سازند، و همچنین با فوتون ها، یعنی با نوری که انرژی را انتقال می دهد، دیگر بار آشنا شویم. این اقبال را هم خواهیم داشت تا به اینکه دنیای نانویی مواد چگونه بر دنیای روزمره ما تاثیر دارند ، و همچنین به اینکه خواص مواد (یعنی شیوه پیوندهای آنها، شکل شان، ساختار آنها) چگونه بر تجربه ما از آنها تاثیر می گذارد، دیگر بار بنگریم و بیاندیشیم. همچنین مروری بسیار مختصر بر چیدمان اتم ها در جدول مندلیف و انواع پیوندهای شیمیایی آنها خواهم داشت. بالاخره اینکه فصل دوم این کتاب فرصتی است که فکر کنیم که چگونه برخی قواعد فیزیکی ویژه در میزان های طولی نانویی تغییر یافته و تبدیل به تاثیراتی کوآنتومی و پر اهمیت می شوند[۹]، و بالاخره اینکه ما چگونه می توانیم، در واقع، چنین موادی نانویی را مهندسی کنیم. [۱۰]
بخش های سازنده[۱۱] دنیای نانو[۱۲]
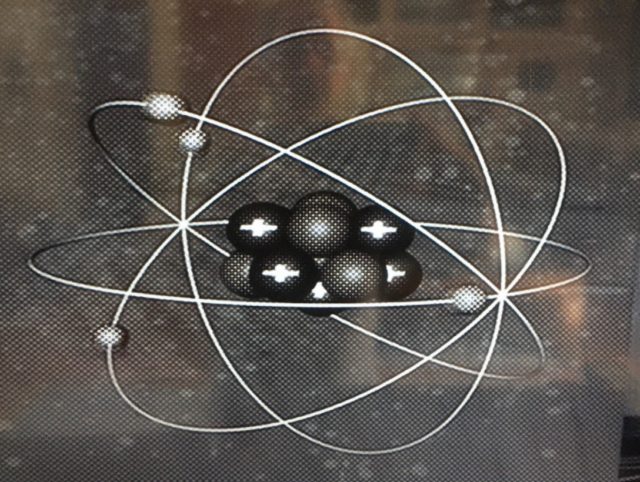
برای شروع شاید بهتر باشد که به مواد و به بخش های سازنده شان نگاهی بیاندازیم[۱۳]، یعنی به تصویری که ما از اتم ها می سازیم[۱۴]. البته یادمان باشد که چنین تصویری تقریبی است و ما آنها را همچون سیاراتی تصویر می کنیم که الکترون ها، همچون ماهواره هایی، بدورشان می چرخند.
سیاره در تصویر بالا هسته اتم است که شامل پروتون ها با باری مثبت و نوترون های خنثی می باشد
ابتدا بساکن اشاره کنم که اگر دانشمندان حوزه ی فیزیک ذره ای[۱۵]، به کارکردهای زیر اتمی و زیر هسته ای و نیروهای مرتبط آنها توجه دارند، دانشمندان حوزه علم نانو و فن آوران نانو اغلب با الکترون ها سر و کار دارند، و به نیروهای الکتریکی و مغناطیسی مرتبط با آنها عمدتا توجه می کنند[۱۶]. آنچه برای چنین دانشمندانی اصولا مهم است این واقعیت است که هسته اتم باری مثبت و جاذبه ای، نسبت به الکترون هایی با باری منفی دارد[۱۷].
برای دانشمندان علم نانو[۱۸]، ماهواره هایی الکترونی در مدارهایی با سطوح افزایشی انرژی، بدور هسته مرکزی در چرخش اند. جدول تناوبی عناصر مندلیف[۱۹] دقیقا بر اساس چنین مدارهایی شکل گرفته شد[۲۰]. در آن جدول، اتم ها بر اساس اینکه در مدار بیرونی خود تا چه اندازه پر و خالی هستند، طبقه بندی شده اند و نمایشگر شاخصه های اتم ها و سطوح انرژی آنها هستند. اتم ها و عناصری که در یک ستون چنین جدولی جا گرفته اند، شاخصه های شیمیایی یکسانی[۲۱] دارند. برای نمونه در ستون نخست دست چپ جدول مندلیف، ما عناصری از قبیل سدیم و لیتیوم را داریم که در آخرین مدار بیرونی خود تنها یک الکترون دارند. چنین تعداد الکترون ها در بیرونی ترین مدار، کلید چگونگی واکنش های شیمیایی این دو عنصر هستند.
دانشمندان فن آوری نانو برای مهندسی مواد، بیش و پیش از هرچیز، به عنوان نخستین نکته، به الکترون های بیرونی ترین مدار اتم ها می اندیشند[۲۲]. کمی بیشتر توضیح دهم[۲۳].
در مقالات “سرشت علم” نوشتم که برای توضیح کارکرد اتم ها، راه حلی ممکن و الگویی اتمی و جدید از طرف فیزیکدانِ دانمارکی نیلس بوهر[۲۴] (۱۸۸۵-۱۹۶۲) مطرح گردید که عجیب و تا حدودی غیرشهودی به نظر می رسید[۲۵].
- بوهر با بکارگیری ابزارهای مدرن و پس از مشاهده ی درخشش اتم هایِ هیدروژن الگوی اتمی خود را مطرح کرد.
- برخلافِ طیف ممتد نور آنگونه که از لامپ ها دیده می شود اتم های داغِ هیدروژن تنها در طول موج های ویژه ای می درخشیدند.
- بوهر مطرح کرد که این طول موج هایِ ویژه بدلیل آن هستند که الکترون ها با تغییر سطحِ انرژی، از سطحی به سطحی دیگر می روند.
- در الگویِ اتمی بوهر، الکترون ها می توانند (بدون هرگونه شتابی) برای مدتی طولانی در یکی از مدارها، دور هسته یمرکزی بمانند. نور هنگامی گسیل می شود که الکترونی از مداری به مداری با انرژی ای پایین تر می جهد.
- کم انرژی ترین مدارِ الکترون ها را وضعیت یا حالتِ پایه[۲۶] می نامند . مدارهای دیگر را وضعیت یا حالتِ برانگیخته [۲۷] می نامند و نور هنگامی تولید می شود که الکترون ها از مداری به مداری پایین تر[۲۸] می جهند.
الگوی بوهر از حوزه ی تجربیاتِ روزمره یِ ما خارج است اما مثال زیر می تواند این الگو را کمی شفاف تر سازد[۲۹].
- سطوحِ متفاوتِ انرژی در اتم ها را می توان به یک پلکان تشبیه کرد. اجسام می توانند بر هر یک از پله ها قرار گیرند اما بینِ پله ها هرگز.
- مدارهای مختلفِ الگوی اتمی بوهر، انرژیِ پتانسیلِ الکترومغناطیسی[۳۰] متفاوت دارند همانگونه که هر یک از پله ها انرژی پتانسیل گرانشی یا جاذبه ای خود را دارند.
- اما تشبیهِ الگوی بوهر به مینیاتوری از منظومه ی خورشیدی درست نیست. در منظومه ی خورشیدی هر یک از سیارات مدار و فاصله ی خود از خورشید را دارند، در حالیکه در مدلِ بوهر چند الکترون می توانند در یک مدار و یک فاصله از هسته ی مرکزی باشند.
الگوی اتمی بوهر یاری داد تا بسیاری از مشخصاتِ ارتباط متقابل یا درهم کنش هایِ ماده – نور[۳۱] توضیح داده شود.
الگوی اتمی بوهر )هم مانند نظریههای علمی اینشتین، رادترفورد و پلانک[۳۲]( مطرح می سازد که انرژی و نور در بسته بندی هایی مشخص[۳۳] که “کوآنتا” نامیده می شوند عملکرد دارند[۳۴].
- کوچک ترین و کم ترین میزانِ انرژی لازم، در نتیجه ی جهشِ یک الکترون از مداری به مداری دیگر است – که جهشِ کووآنتومی[۳۵] نامیده شده است.[۳۶]
- جهشِ کووآنتومی الکترون[۳۷]، از مداری با انرژی بالاتر به مداری با انرژی پایین تر، یک کوآنتوم از اشعه ای الکترومغناطیسی را رها می کند – که فوتون[۳۸] نامیده شده است.
- اگر برعکس، اتمی، فوتونی را جذب کند، یک الکترون به مداری با انرژی بالاتر می جهد.
علم نانو و جدول عناصر مندلیف[۳۹]
تا آنجا که به جدول عناصر مندلیف مرتبط است، و یادمان باشد که چنین جدولی زمین بازی دانشمندان علم نانوست، بهتر می بینم تا توضیحاتی بدهم، و مشخصا به اینکه بخشی از آنچه موفقیتِ مندلیف در بوجودآوردنِ جدولِ عناصرِ خود ارزیابی شده است ، در توجه و توانایی او برایِ پیداکردن (برایِ سنتز[۴۰] یا طرح یابی[۴۱]) وجوهِ تشابه خواص یا خصوصیاتِ فیزیکی – شیمیایی عناصر با یکدیگر و همچنین عدمِ توجه او به وجوهِ تمایز یا تفاوت[۴۲] آنها است[۴۳].
گروه بندیِ عناصر در جدولِ مندلیف به سادگی موردِ قبولِ دانشمندان قرار گرفت چرا که کارکرد و واکنشِ عناصر را به نحوی آزمون پذیر پیش بینی می کرد و چنین جدول بندی ای با روشِ علمی همخوانی داشت. )نگاه کنید به پی نوشت د(
البته از یاد نبریم که بکارگیری ابزارهایی نو و کشفِ عناصرِ جدید هم، یکی پس از دیگری، موجب گسترش جدول مندلیف شدند.[۴۴]
- برای نمونه اختراع و توسعه ی طیف نمایِ شعله ای[۴۵] سبب کشف عناصر بسیاری بین سالهای ۱۸۷۰ تا ۱۸۹۰ شد. بیش از ۲۰ عنصرِ جدید از جمله عناصرِ کمیابِ زمینی (با وزنِ اتمی ۵۷ تا ۷۱) و همچنین گازهایی که خنثی یا بی اثر (بی کنِش[۴۶]) نامیده می شوند بدین روش کشف شدند.
- جداسازیِ فلورین[۴۷] از چالش هایِ بزرگِ شیمیدان های قرن ۱۹ بود و بالاخره شیمیدانِ فرانسوی هانری موآسان[۴۸] پس از سه سال تلاش و خطر کردن موفق به جداسازی آن شد[۴۹].
- ماری کوری[۵۰] لهستانی و همسرش پییر کوری با بکارگیری ابزارهای نو نخستین عناصر رادیوآکتیو یعنی پلوتونیوم و رادیوم را در سال ۱۸۹۸ جداسازی کردند[۵۱]. این عناصر به نحوی خودانگیخته از خود اشعه هایی با انرژی بالا گسیل کرده و به عناصری دیگر تبدیل می شوند.[۵۲]
بوجود آمدن الگویِ اتمیِ بوهر موجبِ شناختِ بیشتری از چگونگیِ کارکردِ جدولِ عناصر شد. آن جدول دو شاخصه ی کلیدی عناصر را به نحوی سیستماتیک طبقه بندی کرد: وزنِ اتمی[۵۳] آنها و خواصِ شیمیایی شان را.
- وزن (یا جرم) عناصر در جدولِ مندلیف از چپ به راست و از بالا به پایین افزایش می یابد. رادترفورد نشان داده بود که تقریبا همه ی جرمِ هر اتمی باری مثبت دارد و در هسته ی مرکزی آن متمرکز است[۵۴]. افزایشِ وزن رابطه ای مستقیم با اندازه ی هسته ی مرکزی آن اتم و با میزانِ بار مثبتِ آن دارد.
- “شماره یِ اتمی[۵۵]” هر عنصر جایگاهِ آن را در جدولِ مندلیف و تعدادِ پروتون های اش را در هسته ی مرکزی مشخص می کند.
- در مدارهای اتم هایی با باری خنثی تعدادِ کل الکترون ها با تعدادِ کل پروتون های آن اتم در هسته ی مرکزی برابرند. در هر اتمی تعدادِ نابرابری الکترون و پروتون، اتمی باردار (یا یون ها[۵۶]) را می سازد.
عملکردِ شیمیایی هر عنصری بازتابی از درهم کنشِ دو یا بیشتر الکترون، در هر اتم اند.
- خواص یا خصوصیاتِ تناوبیِ عناصر در جدولِ مندلیف نشان می دهند که آن عناصر که عملکردهایی مشابه دارند[۵۷]، چیدمانِ مشابهی هم از الکترون های مدارِ بیرونی دارند[۵۸]. ستون هایِ عمودیِ آن جدول نشان می دهند که آن عناصر چیدمان هایِ مشابهِ الکترونیِ مدارهای بیرونی[۵۹] دارند.
- ستون هایِ افقیِ جدولِ عناصر، در تطابق با مدارهایِ اتمی الکترون ها بدورِ هسته ی مرکزی آنها، چیده شده اند.
- با حرکت از چپ به راست در هر ستونِ افقیِ جدول عناصر، بار مثبتِ هسته یِ مرکزی (یعنی تعدادِ پروتون ها) افزایش می یابد. نتیجتاً برای اینکه هر اتمی باری خنثی داشته باشد مدارِ خارجی آن نیز باید افزایشِ الکترونی داشته باشد.
کلیدِ شناخت آنکه اتم ها چگونه در هم ترکیب می شوند در این واقعیت است که “شمارگانِ جادویی[۶۰]” برخی الکترون ها در هر اتمی از شمارگانِ دیگر پایدارتر است. پایدارترین یا باثبات ترین چیدمانِ الکترون ها، دقیقا شمارگانِ ۲، ۱۰، ۱۸، ۳۶ ، ،۵۴ یا ۸۶ الکترون دارند[۶۱].
می توان به فعل و انفعالاتِ شیمیایی به نحوی نگریست که اتم ها در پیوند یا در بهم پیوستگی[۶۲] با دیگر اتم ها، برای ثباتی بیشتر در جستجوی این “شمارگان جادویی” هستند، یعنی چیزی که پیوند یا بهم پیوستگی شیمیایی نامیده می شود.[۶۳])نگاه کنید به پی نوشت د(
همانگونه که پیشتر اشاره کردم، فن آوران نانو برای مهندسی مواد، بیش و پیش از هرچیز، به عنوان نخستین نکته، به الکترون های بیرونی ترین مدار اتم ها می اندیشند[۶۴]. نکته دوم و بنیادین برای دانشمندان علم نانو، پیوند الکترون هاست[۶۵].
از آنجا که اتم ها در جستجوی آن اعداد جادویی هستند، برای ثبات گرایش به پیوند با دیگر اتم ها دارند. برای نمونه عناصری در ستون نخستین چپ جدول مندلیف که تنها یک الکترون در بیرونی ترین مدار خود دارند، بسادگی گرایش به پیوند با عناصری دارند که در بیرونی ترین مدار خود، یک الکترون کم دارند. نمک معمولی یعنی کلرید سدیم نمایشگر پیوندی بین سدیم با یک الکترون در مدار بیرونی خود و کلری با هفت الکترون در بیرونی ترین مدار خود می باشد که در پیوند، هر دو عنصر به یکی از همان اعداد جادویی می رسند. در چنین پیوندی شیمیایی که پیوند یونی نامیده می شود، ثبات شکل گرفته است.
بدلیل اهمیت پیوندهای شیمیایی در علم نانو و بویژه در رویکرد پایین به بالا در فن آوری نانو که در سرتاسر این کتاب به آن پیوندها اشاره خواهم داشت[۶۶]، در اینجا باز هم نیاز به توضیحاتی پیرامون پیوندهایی شیمیایی، که همگی در جستجوی ثبات اند، می بینم.
کلیدِ درکِ چنین پیوندها یا چنین بهم پیوستگی ها را در انرژی می توان جستجو کرد: یعنی تمامِ سیستم هایِ طبیعی، گرایش به ثبات در حالت پایین ترین تراز انرژی[۶۷] دارند.
- شاید مثالِ زیر برایِ توضیحِ این نکته به ما یاری دهد. کوهی پرشیب با دره ای عمیق را فرض کنیم که سنگ های بزرگی[۶۸] در آن داریم. مسلما پایدارترین و باثبات ترینِ این سنگ ها در کفّ و یا در عمقِ آن دره اند؛ و برای حرکتِ آنها به انرژی نیاز داریم.
- سنگ هایی هم در سراشیبی آن دره قرار دارند که انرژیِ پتانسیلِ گرانشی یا جاذبه ای[۶۹] بیشتری دارند. هرچه سنگ ها در ارتفاعی بالاتر، انرژیِ پتانسیل آنها بیشتر است. یک زمین لرزه ی کوچک به راحتی می تواند آنها را به عمقِ دره سرازیر کند؛ و در آن فرآیند انرژیِ پتانسیلِ آنها به گرما تبدیل می شود.
چیدمانِ الکترون ها در هر اتم شبیه به موقعیتِ سنگ هایِ آن دره هستند.
- چیدمانِ الکترونی ای که مدارِ بیرونی اتم را کامل کرده باشد (آن شماره هایِ جادویی را داشته باشد، برای نمونه گازهای خنثی[۷۰]) پایین ترین انرژیِ پتانسیلِ شیمیایی را داراست و مانند سنگ هایِ در عمق یا در کفِّ آن دره است[۷۱].
- چیدمانِ مدارِ بیرونی ای که ناکامل است انرژیِ پتانسیلِ شیمیایی بالاتری دارد. هرگونه گذار به چیدمانی که مدارِ بیرونی را کامل کند، با رهاکردن انرژی[۷۲] همراه است.
- تعدادِ متفاوتِ الکترون ها در مدارِ بیرونی اتم را می توان به ارتفاع هایِ متفاوتِ سنگ ها در آن دره تشبیه کرد.
- اگر چیدمان های مشخصی از الکترون ها در مدارِ بیرونی ناپایدار نبودند، نیازی نبود تا اتم ها به یکدیگر بهم پیوسته شوند. ناپایداری دلیلِ بهم پیوستگی یا پیوند اتمی است[۷۳].
اتم ها سه استراتژی و رویکردِ متفاوت[۷۴] برای اتصال و بهم پیوستگی (پیوند) به یکدیگر دارند: بهم پیوستگیِ یونی، بهم پیوستگیِ فلزی و بهم پیوستگی (پیوندِ) اشتراکی یا کووالانسی[۷۵] .
همانگونه که پیشتر در مورد نمک معمولی اشاره کردم، پیوندِ یونی یکی از سه نوع بهم پیوستگی هایِ شیمیایی اتم هاست. اتم هایی که در مدارِ بیرونی شان آن شماره ی جادویی از الکترون را دارند، بسیار پایدارند. اتم هایی که یک یا دو الکترون از آن شماره ها کمتر دارند، ناپایدارترینِ[۷۶] اتم ها هستند.
- کلر (عنصرِ با شماره ی اتمی ۱۷) یکی از خطرناک ترین واکنش ها را دارد زیرا برای کامل کردنِ مدارِ بیرونیِ خود (و کسبِ حالتِ ۱۸ الکترونی – همان عدد جادویی) با هر عنصرِ دیگری فعل و انفعال دارد. سدیم هم که ۱۱ الکترونی است، برای ازدست دادنِ ۱ الکترون و برای باثبات شدن، به آب و حتی به هوا هم واکنش نشان می دهد. پیوندهایِ یونی که اغلب موادی سخت چون سنگ، شیشه و یا سرامیک می سازند، از هر دو نوعِ فرآیندهایِ برشمرده استفاده می کنند.
- وقتی اتمِ کلر و اتمِ سدیم بهم نزدیک می شوند واکنشی سریع و شدید[۷۷] دارند و اغلب شعله ی داغ و پرحرارتی هم که نشانه ی آزاد شدنِ انرژی است تولید می کنند . در این فرآیند، کلر یک الکترون از سدیم گرفته و هر دو اتم به حالتِ پایدار الکترونی می رسند.
- هر دو اتم در این فرآیند، به یون هایِ باردار[۷۸] تبدیل می شوند. کلر به یونی با بارِ منفیِ ۱ و سدیم به یونی با بارِ مثبتِ ۱ تبدیل می شود و بارهای مثبت و منفی یکدیگر را جذب کرده و پیوندِ شیمیایی ای که پیوندِ یونی نامیده می شود بوجود می آورند.
- نمونه های بسیار زیادی از پیوندهایِ (بهم پیوستگی های) یونی در اطرافِ ماست. همه ی عناصری که در ستونِ عمودیِ اولِ دستِ چپِ جدولِ عناصرِ مندلیف هستند (یعنی همان فلزهایِ قلیایی[۷۹]) با عناصرِ ستون (دوم یا) یکی مانده به آخر از دستِ راستِ آن جدول (هالوژن ها،[۸۰]) پیوندهای یونی که نسبتِ ترکیباتِ آنها ۱:۱ است می سازند و انواعِ نمک ها را بوجود می آورند (مانند نمک معمولی یا کلرید سدیم.)
- همه ی عناصری که در ستونِ عمودیِ اولِ دستِ چپِ جدول عناصر مندلیف هستند (فلزهای قلیایی،) هم با عناصرِ ستون سوم یا با عناصرِ دو ستون مانده به آخر از دست راست آن جدول، پیوندهای یونی می سازند اما نسبتِ ترکیباتِ آنها ۱:۲ است.
- یکی از فراوان ترین نمونه های پیوندِ یونی بینِ سیلیکن (عنصر ۱۴) و اکسیژن (عنصر ۸ جدول) صورت می پذیرد که فرمولِ شیمیایی آن SiO۲ است و کوارتز[۸۱] نامیده می شود و همان شن هایِ ساحلی و بسیاری دیگر موادِ معدنی ای هستند که شیشه، چینی و سرامیک را می سازند. همچنین ماده معدنی کوروندوم که در یاقوتِ سرخ و یاقوتِ سیاه است[۸۲] و بسیار سخت است پیوندی یونی دارد. اگر به خاطر داشته باشید مطابق با قانونِ کولومب [۸۳] نیرویِ الکتریسیته ی ساکنِ بینِ دو ذره، ارتباطی مستقیم با بارهای آنها دارد.[۸۴]
پیوندهای یونی ویژگی های بارز زیر را دارند. اغلب چنین ویژگی هایی در ابعاد نانو، به کلی تغییر می کنند که در سرتاسر کتاب “سفر به ریزها” بدانها اشاره خواهم داشت.
- نیرویِ قویِ بین یون های مثبت و منفی در پیوندهای یونی موادی بسیار سخت اما ترد و شکننده[۸۵] می سازند، مانند چینی، شیشه و سنگ ها.
- امواجِ نور به سادگی با برخورد به الکترون ها دچارِ انکسار و پراکندگی و پخش شدگی می شوند و چون در پیوندهایِ یونی الکترون ها در مدارهای کامل شده و پایدار هستند، نور به سادگی از آنها عبور می کند.
- چون الکترون ها در ترکیباتِ یونیِ بسیار محکمی در مدارهایِ خود جا دارند آن مواد بهترینِ نارساناها [۸۶]یا عایق ها هم هستند.
دومین نوع پیوند شیمیایی بهم پیوستگی هایِ فلزی[۸۷] نام دارد که اتم ها در آن پیوندها الکترون ها را شریک می شوند.[۸۸]
- در فلزِ سدیم، هر اتمی یک الکترون را رها می کند و دریایی از الکترون های ناپیوسته[۸۹] با باری منفی را بوجود می آورد. یون هایِ سدیم مانندِ جزایری با بار مثبت[۹۰] در دریایی از الکترون ها هستند.
- بیش از دو سومِ عناصرِ جدولِ مندلیف پیوندهایِ فلزی بوجود می آورند[۹۱].
- تمامِ عناصری که در مدارِ بیرونیِ خود الکترون هایی کمتر از مداری نیمه کامل و یا نیمه پرشده[۹۲] دارند پیوندهایِ فلزی می سازند.
- بیشتر ترکیباتِ عناصرِ فلزی هم که آلیاژ نامیده می شوند پیوندِ فلزی دارند. شناخته شده ترینِ آلیاژها برنج[۹۳] (آمیزه ی مِس[۹۴] و روی[۹۵]،) برنز[۹۶] (ترکیب مس و قلع[۹۷]) و پیوتر[۹۸] (آمیزه ی قلع و آنتیموان[۹۹] و یا ترکیب قلع و سرب[۱۰۰]) هستند.
- فولادهایِ مدرن، آلیاژِ[۱۰۱] آهن و کربن و اغلب چند فلزِ دیگر هستند و هریک ویژگیِ مختصِ خود را دارند[۱۰۲].
- استفاده از فلزاتِ سبک تر (از قبیل آلومینوم و تیتانیوم) در صنایعِ حمل و نقل و همچنین در هواپیماسازی با قانونِ دومِ نیوتن همخوانی دارد که فرمولِ آن اینگونه بیان شد:
F=m x a و یا a=F/m
که a برای شتاب و m برای جرم است و نشان می دهد که با اعمال نیرویی ثابت با سبک تر کردن و کاهشِ جرم می توان شتاب هایِ بالاتری را بدست آورد.[۱۰۳]
پیوندهایِ فلزی هم خواص یا خصوصیاتِ ویژه ی خود را دارند که آنها نیز در ابعاد نانو تغییراتی عمده دارند.
- پیوندهای فلزی بین اتم هایی با بارِ مثبت در دریایی از الکترون هایی با بار منفی، تواناییِ چکش پذیری[۱۰۴] دارند و شکنندگیِ پیوندهای یونی را ندارند . نتیجتاً بیشترِ فلزها را می توان خم کرد.
- الکترون های در گردش در پیوندهای فلزی نور را منعکس می کنند و بهمین دلیل اکثرِ فلزها سطحی درخشنده دارند[۱۰۵].
- چون الکترون ها در پیوندهای فلزی آزاد هستند، فلزات اغلب رسانا[۱۰۶] هستند.
سومین نوعِ بهم پیوستگی های شیمیایی پیوندهایِ کووالانسی[۱۰۷] هستند که الکترون ها را به شیوه ی دیگری سهیم می شوند[۱۰۸].
- هنگامیکه دو اتمِ هیدروژن بهم نزدیک میشوند هریک از آنها یک الکترون و یک پروتون دارد و چون اتم ها برای پایداری نیاز به مدارِ بیرونیِ کاملی دارند، آن دو اتم به شکلِ ملکول H۲ (که گاز است) الکترون هایِ خود را با یکدیگر سهیم می شوند که پیوندی کووالانسی است.
- این نوعِ پیوند از پیوندِ H-H که بین یونی با بار ۱+ و یونی دیگر با بار ۱ -است متفاوت است.
- این نوعِ پیوند از پیوندِ فلزی هم، که همانگونه که پیشتر گفته شد گویی در آن پیوند پروتون ها در دریایی از الکترون ها هستند، متفاوت است.
بیشتر پیوندهایِ غیرفلزها کووالانسی هستند.
- مولکول گازهایِ بسیاری از قبیل اکسیژن O۲ و نیتروژن N۲ کووالانسی اند.
- در آب هم، دو اتم هیدروژن الکترون هایِ خود را کووالانسی با اتم اکسیژن سهیم می شوند تا اکسیژن به ثبات ۱۰ الکترونی یعنی به آن عدد جادویی برسد.
- منعطف ترین[۱۰۹] عنصری که پیوندِ کوالانسی می سازد عنصرِ شماره ی ۶ یعنی کربن C است که بدلیل اهمیت بی اندازه ی آن عنصر در دنیای فیزیکی و شیمیایی، من هم در “سفر به ریزها” به تفصیل بدان خواهم پرداخت.
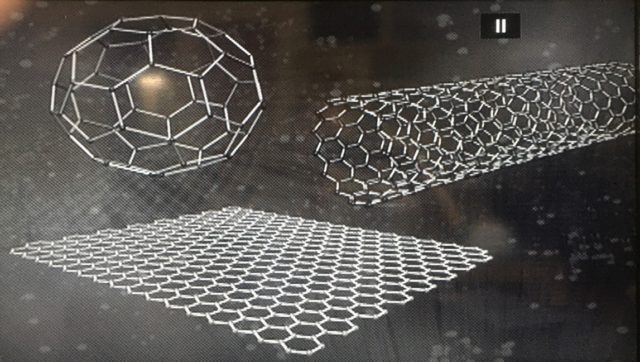
در اینجا بهتر است اشاره کنم که بسیاری از ملکول های بزرگ تری که در سفر به ریزها بدانها خواهم پرداخت از قبیل ملکول دی ان ای[۱۱۰] یا پروتیین ها[۱۱۱]، یعنی شکرهایی که کالبد ما را می سازند[۱۱۲]، و همچنین شکرهایی که در فرآیند فتوسنتز بوجود می آیند، همین ثبات پیوندی را به نمایش می گذارند. حتی مصنوعات علم نانو[۱۱۳] از قبیل نانو توپ های کربنی یا نانو لوله های کربنی[۱۱۴] هم ساختارهایی متکی بر پیوندهای با ثبات شیمیایی اند[۱۱۵]. نانو لوله های کربنی استحکام بالایی دارند و در تجهیزات ضد گلوله، کامپوزیت های پولیمری و در لاستیک هواپیما کاربرد دارند.
پیش از ادامه بحث، بخاطر داشته باشیم که در علم نانو، مدیریت سطح تماس دو ماده بهنگام پیوند با یکدیگر[۱۱۶]، یا مدیریت آن پهنه ی مرزی[۱۱۷] بین دو ماده[۱۱۸]، از اهمیت خاصی برخوردار است[۱۱۹].
تصویر کلاسیک نور
خوب تا اینجا در مورد بخش های سازنده مواد و پیوندهای شیمیایی آنها نوشته شد، یعنی پیرامون اجسامی که جرم دارند. اما انرژی چه؟ انتقال انرژی چگونه است[۱۲۰]؟
بهتر می بینم که با مبحث انرژی، رنگ، طیف نوری از منظر موج ها و اشعه های نوری طیف الکترومغناطیسی شروع کنم. چنین بحثی مسلما نیاز به آشنایی با فوتون ها دارد. تصویر موجی فوتون ها در طیف الکترومغناطیسی، نوسانی هم در حوزه الکتریکی و هم در حوزه مغناطیسی دارد[۱۲۱].
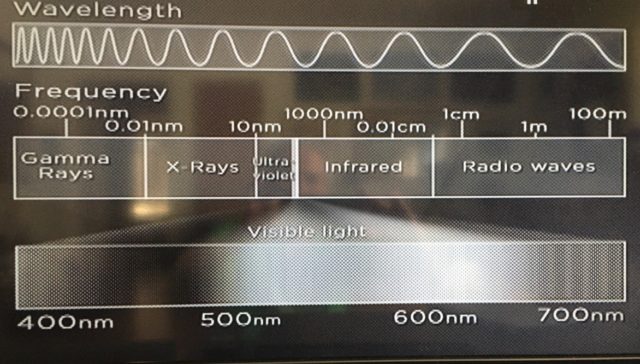
- اگر برای نمونه به نوسان الکتریکی نوری تک رنگ (مونوکروماتیک[۱۲۲]) بیاندیشیم، اندازه ی نوسانی مشخصی را در فضا و زمان می بینیم. چنین اندازه ای در فضا، طول موج خوانده می شود. نور طیف قابل رویت برای ما، طول موجی بین ۴۰۰ تا ۷۰۰ نانومتر دارد، و اگرچه همانگونه که در تصویر بالا مشاهده می شود،با نانومتر اندازه گیری می شود در واقع به مقیاس طولی میکرومتر نزدیک تر است[۱۲۳].
- البته نام “قابل رویت” در ارتباط با ویژگی تکاملی چشم ما انسان ها برگزیده شده است. از آنجا که خورشید بسیار پر حرارت بوده و برون فرستی ای عمدتا زرد رنگ داشته است، تکامل یا فرگشت سیستم بینایی ما، در طول هزاره ها، در آداپته کردن خود با چنین برون فرستی و با طیف های نوری دو طرف رنگ زرد شکل گرفته است[۱۲۴]. ما انسان ها چنین طیفی را “قابل رویت” می نامیم[۱۲۵] اگرچه برای برخی دیگر از موجودات، برای نمونه افعی ها، نور قابل رویت در طیف فروسرخ[۱۲۶] است که طول موجی بسیار طولانی تر از توانایی دیدن یا توانایی رویت ماست، و آن جانوران با استفاده از آن مولفه فروسرخ و گرمایی[۱۲۷]، که محصول آداپته شدن آن جانوران بوده است، شکار خود را می یابند.
- تا آنجا که به طیف الکترومغناطیسی باز می گردد، در دیگرسو با طول موج هایی کوتاه تر و کوتاه تر روبرو هستیم. با استفاده ابزاری از چنین طول موج هایی کوتاه، دانشمندان قادرند تا ساختارهای ریزتر را با دقت[۱۲۸] و فروکاوی فضایی ظریف تری[۱۲۹]، مشاهده کنند. برای نمونه، با استفاده از ابزارهای نور فرابنفش[۱۳۰] قادریم ساختارهای بسیار کوچک را، دقیق تر و بی نهایت ظریف تر از آنچه با نور قابل رویت میسر است، ببینیم و البته هنگامی که از اشعه ایکس[۱۳۱]، که طول موجی کوتاه تر دارد، استفاده می کنیم، دقت و ظرافت بیشتر می شود.
فن آوری نانو و تاثیر فتوالکتریک[۱۳۲]
ما تا بحال در مورد نور به عنوان موج اشاره داشته ایم که البته مفهومی بسیار سودمند برای علم نانوست. آلبرت اینشتین برای کشفیات علمی خود و بینش های ویژه اش معرف همه هست، اما در مورد یکی از مباحث علمی وی پیرامون تاثیر فتوالکتریک[۱۳۳] کمتر نوشته شده است[۱۳۴].
این مبحث علمی اینشتین در فن آوری نانو بسیار مفید بوده است.
- چنین نظریه ای علمی، کیفیت ذره مانندی نور را مطرح کرد و اینشتین آن را از دیدگاه تجربی و آزمایشی به ثبت رساند. آزمایش اینشتین از طریق انتخاب فلزی بود که، بوسیله نورهایی گوناگون از طیف الکترومغناطیسی، مورد تابش قرار داده شد.
- با تابش نورهایی با طول موج هایی بلند تر، هیچ تاثیری فتوالکتریک مشاهده نمی شد، حتی اگر آن نور با شدتی بسیار بالا بر فلز می تابید. این بدان مفهوم بود که چنین فلزی (و البته آزمایش های او بر فلزاتی مختلف، بارها انجام شد،) حتی با تابش شدید نوری با طول موج بلند، تهییج نشده و الکترونی را هم به بیرون نمی فرستاد[۱۳۵].
- با تابش تدریجی نورهایی با طول موج هایی کوتاه تر و کوتاه تر، بالاخره فلز تهییج شده و برون فرستی الکترون های بسیاری را به نمایش گذاشت[۱۳۶]. شدت برون فرستی الکترون ها[۱۳۷] با شدت نور در چنان طول موجی کوتاه، نسبتی مستقیم داشت و اندازه گیری شد[۱۳۸]. اینشتین چنین پدیده ای را تاثیر فتوالکتریک نامید[۱۳۹].
- توضیح علمی اینشتین چنین بود که الکترون های مدار بیرونی اتم آن فلز می بایست به درجه ای از تهییج و نتیجتا به سطح انرژی مشخصی می رسیدند تا بتوانند از اتم آن فلز بگریزند، و تنها فوتون هایی با طول موج های کوتاه تر قادر به ایجاد چنان سطحی از انرژی بودند. با تابش نورهایی از طیف الکترومغناطیسی با طول موج هایی کوتاه تر، جریان فوتون ها افزایش یافته تا به آستانه چنان سطحی از انرژی[۱۴۰]، برای رهایی الکترون ها از مدار بیرونی شان، برسند. در حالی که تابش هرچه شدیدتر نورهایی با طول موج هایی بلندتر، هرگز چنین تاثیری فتوالکتریک را بوجود نمی آورد. اینشتین چنین آزمایشی را در سال ۱۹۰۵ بارها برای فلزهایی مختلف انجام داد و در سال ۱۹۲۱ برای آن جایزه نوبل گرفت[۱۴۱].
- توضیح علمی اینشتین چنین بود که برای هر فلزی، سطح معینی از انرژی لازم است تا الکترون ها تهییج و رها شوند، و اینکه تنها فوتون هایی با طول موج هایی کوتاه تر، انرژی لازم برای چنین پدیده ای را داشتند.
- او هم به فوتون ها به عنوان بسته های اتم مقداری انرژی یا کوآنتا اشاره کرد و گفت که تناسب و رابطه ای معکوس بین طول موج فوتون ها و چنین بسته هایی کوآنتایی موجود است[۱۴۲]. هرچه طول موج کوتاه تر، انرژی کوآنتایی بیشتر است. بهمین دلیل هم طول موج های کوتاه تر، انرژی لازم برای رهایی الکترون های مدار بیرونی فلزات را داشتند.
- همین مفهوم اینشتینی بسته های کوآنتایی و نقش فوتون ها (هم به عنوان ذره و هم موج) در طراحی بسیاری مواد نانویی و کارکردشان مورد استفاده است[۱۴۳].
- از سویی دیگر و برای نمونه، امروز در علم پزشکی هنگامی که تصویربرداری های گرمایی[۱۴۴] انجام می گیرند، در واقع ما از فوتون هایی با انرژی پایین استفاده می کنیم. هنگامی که از فردی، در اتاقی نسبتا خنک، تصویربرداری های پزشکی می شود، در حقیقت ما فوتون هایی با انرژی پایین گرمایی برون فرستاده شده از کالبدی را جمع آوری می کنیم، که از دمای پس زمینه و محیط چنین فردی، کمی گرم تر هستند[۱۴۵].
- برای نمونه ای دیگر، دلیل سرطان زا بودن اشعه های فرابنفش (که از نور قابل رویت طول موجی کوتاه تر دارند،) در انرژی فوتون های آنهاست. چنین انرژی کوآنتایی بیشتر می تواند با دی ان ای و دیگر پروتئین ها درهم کنش داشته و به تهییج بیش از اندازه الکترون هایی در کالبد اتمی ما بیانجامد[۱۴۶]. چنین چیزی، واکنش های ناخوشآیندی را سبب می شود که می تواند به دگرش هایی بدخیم در سلول های ما منجر شود. بهمین ترتیب هم، طول موج های کوتاه تر فوتون هایی مانند اشعه ایکس و اشعه گاما، بسته های کوآنتایی انرژی بسیار بیشتری داشته و احتمال میزان صدمات آنها به کالبد ما بسیار بالاتر است.
خواص مواد نانویی[۱۴۷]
ارتباط بین ماده و نور بسیار مهم است زیرا که ما در علم و فن آوری نانو همواره سعی در مهندسی موادی نانویی داریم که قادر به برون فرستی نور و یا انعکاس نور باشند[۱۴۸]. هم چنین مایل هستیم که این مواد بتوانند نور را به جریانی برقی، یا برعکس جریان برقی را به نور تبدیل کنند[۱۴۹].
جالب اینجاست که بدانیم که شیشه رنگی هایی[۱۵۰] که قرن هاست برای کلیساها ساخته شده اند، از نظر علمی بخاطر تاثیرهای نانویی ذرات فلزات است، که رنگین هستند. این یعنی خمیری که هنرمندان شیشه رنگی ساز، برای مثلا رنگ های سرخ یا زرد، تهیه می کنند، در واقع ذرات ریز فلزاتی هستند که نوسان های نوری متفاوت دارند[۱۵۱]. امروزه این پدیده تاثیرهای نانویی را در حوزه علم، پلاسمونیک[۱۵۲] می نامند که به کارکردهای بسته های کوآنتایی انرژی فوتون ها[۱۵۳] اشاره دارد[۱۵۴].
خواص (مکانیکی، برقی، و غیره) معمولی مواد[۱۵۵] که مشهود هستند، در واقع صورت خارجی[۱۵۶] درهم کنش هایی در مقیاس های طولی نانویی هستند. برای توضیح ساده تر چنین پدیده ای، یکی از راه ها مشاهده موادی است که از نظر ترکیبی (در جدول مندلیف) یکسان هستند اما خواص بسیار متفاوتی را، بدلیل نوع پیوند شیمیایی شان، به نمایش می گذارند. نمونه ای خوب، عنصر کربن است که در گروه چهارم جدول عناصر قرار دارد و ماده ی سازنده ی الماس است. همانطور که پیشتر اشاره کردم، کربن می تواند پیوند هایی کووالانسی برای رسیدن به همان اعداد جادویی داشته باشد. همه می دانیم که الماس ماده ای شفاف و بسیار سخت است و دلیل سختی الماس در ساختار منظم قرینه وار آن ماده، در سویه های متفاوت و همچنین در شکل گیری نوعی قرینگی کروی آن است که متشکل از شش ضلعی و پنج ضلعی هایی منظم است. چنین ساختاری هیچ سطح مشخصی آسیب پذیر یا صدمه پذیر ندارد.
اما در عین حال ما گرافیت[۱۵۷] را داریم که برساخته کربن است و در نوک مداد استفاده می شود. نوشتم که گرافیت کربن پایه است و از همان ماده ای ساخته شده که الماس را می سازد، اما گرافیت بنحوی باورنکردنی متفاوت است. گرافیت برخلاف الماس، نرم و کدر است. خوب این چگونه است[۱۵۸]؟
برای پاسخ، نیاز به شناخت ساختار مقیاس نانویی گرافیت داریم. در ساختار گرافیت، اتم های کربن بر روی صفحه ای با یکدیگر پیوند می خورند و این صفحات بنحوی لایه لایه[۱۵۹] و افقی بر روی یکدیگر می نشینند و می توانند بر یکدیگر بلغزند[۱۶۰]. نیروهای درهم کنشی چنین صفحاتی مسطح و افقی، در مسیر و راستای عمودی ضعیف تر هستند[۱۶۱].
از سویی دیگر همین پیوندها در مقیاس های نانویی صفحه ای، برای رسیدن به خواصی کاملا متفاوت در ماده ای دیگر بنام گرافین[۱۶۲]، مورد استفاده است که در طراحی و مهندسی نانوساختار توپ های کربنی[۱۶۳] و نانو لوله های کربنی[۱۶۴] استفاده می شوند[۱۶۵]. خواص نوری و برقی[۱۶۶] گرافین هم بسیار از الماس متفاوت است[۱۶۷]. در الماس، ما نیاز به فوتون هایی در طول موجی فرابنفش و کوتاه تر داریم تا به درجه ای از تهییج برای جذب نور برسیم[۱۶۸]، در حالیکه در گرافین و همچنین در گرافیت، ما بسیاری الکترون های در دسترس داریم که گرافین و گرافیت را عمدتا به موادی رسانا تبدیل می کند. این خاصیت، بسادگی برای جریان برق و همچنین جهت جذب نور در طول موج های متفاوت یا گوناگون، مورد استفاده است.
عکس بالا نانو لوله های کربنی (بالا دست راست،) نانو توپ های کربنی (بالا دست چپ) و گرافیت (پایین) را نشان می دهد
دنیای کوآنتومی
یکی از هیجان انگیزترین حوزه های فن آوری نانو، پژوهش و استفاده از موادی نانوساختاری[۱۶۹] است. تاثیرهای کوآنتومی[۱۷۰] ساختارها، در چنین مقیاس های طولی نانویی پدیدار می شوند[۱۷۱]. پژوهش ها به دانشمندان نانو توانایی کنترل بر کارکرد مواد را می دهند و همچنین مهارتی فنی را می دهند تا موادی را با خواص طراحی شده ی نوین[۱۷۲]، مهندسی کنند.
- در این حوزه های پژوهشی، طبقه جالب نوینی از مواد هستند که، همانگونه که پیشتر اشاره کردم، نقطه های کوآنتومی[۱۷۳] نامیده شده اند. چنین نقطه هایی[۱۷۴] از سرشت موج مانند الکترون ها بهره می برند[۱۷۵]. شناخت چنین سرشتی هم به شناخت کارکرد ویژه الکترون ها انجامیده است که حوزه ای بسیار اساسی در فن آوری نانوست.
- اگرچه در فیزیک کلاسیک، الکترون ها را همچون ذراتی (ماهواره هایی) تصویر کرده ایم که بدور هسته ی مرکزی در چرخش هستند، اما در مکانیک کوآنتومی، خاصیت دوگانه موج ذره ای[۱۷۶] الکترون ها به اثبات رسیده است و نشان داده شده که الکترون ها هم، بغیر از ذره بودن، گستره ی فضایی ای موج گونه دارند که، در مقیاس های طولی، حدودا دو نانومتر هستند.
- موج الکترونی می تواند نموداری (نگاه کنید به در تصویر زیر) داشته باشد که شلجمی شکل یا بشقابی شکل باشد، اما در عین حال می تواند نوساناتی[۱۷۷] نزدیک به موادی یا به اتم هایی (که خود بخشی از آنها هستند) گرفته، ساختارهایی موج گونه و پیچیده بسازند.
تصویری نوین از توزیع موجی الکترونی
- در مقام مقایسه با فوتون ها که در موردشان نوشته شد، باید بخاطر بسپاریم که فوتون ها در طول موج هایی بلندتر (چند صد نانومتری) هم می توانند موج مانند باشند، اما الکترون ها خاصیت موج مانند و گستره ی فضایی[۱۷۸] خود را تنها در مقیاس های چند نانومتری نمایان می سازند. نقطه های کوآنتومی هم، همین خواص موج مانند مواد نیمه رسانا را در طول موج های کوتاه تر بنمایش می گذارند.
- برای نمونهدر دنیای فن آوری نانو با ذراتی نیمه رسانا روبرو می شویم که ترکیب شیمیایی ای یکسان[۱۷۹] دارند، اما رنگ هایی متفاوت را بیرون می فرستند[۱۸۰]. دلیل چنین پدیده ای، اندازه های گوناگون ذرات[۱۸۱] است. در ذرات بسیار ریز، موج الکترونی[۱۸۲] در بسته ای اتم مقداری یا جعبه کوآنتایی ای کوچک تر قرار گرفته می شود و فشرده تر است[۱۸۳]، و نتیجتا سطح انرژی بالاتری[۱۸۴] برای رهایی الکترون دارد. هنگامی که برعکس، ذرات نانویی در بسته های کوآنتایی بزرگ تری قرار می گیرند، موج الکترونی آنها کمتر فشرده شده و سطح انرژی پایین تری دارد.
- چنین تاثیرات کوآنتومی[۱۸۵]، که از خواص موج مانند مواد در ابعاد نانو بهره می برند[۱۸۶]، توسط دانشمندان فن آوری نانو برای مهندسی نیمه رساناهایی تنظیم شونده[۱۸۷] استفاده می شوند.
- سرشت اجتناب ناپذیر موج مانند[۱۸۸] الکترون و همچنین خاصیت ویژه کوآنتومی[۱۸۹] برشمرده آن، به ما توانایی طراحی و تنظیم موادی نوین در مقیاس های نانویی را می دهد[۱۹۰].
- در عین حال، پدیده غریبی که در علم نانو “تونل زنی کوآنتومی[۱۹۱]” نامیده می شود[۱۹۲]، تاییدی بر سرشت دوگانه موج ذرّه ای[۱۹۳] الکترون[۱۹۴] است که هم ذرّه است، و هم موج در ابعاد چند نانومتری[۱۹۵].
- همانگونه که پیشتر در مورد پلاسمونیک و در مورد بسته های کوآنتایی فوتون هایی موج مانند نوشته شد[۱۹۶]، در مورد الکترون ها هم، ما با بسته های کوآنتایی موج مانند الکترون، در نقطه های کوآنتومی روبرو هستیم.
- نکته بسیار پر اهمیت برای دانشمندان فن آوری نانو در مورد نقطه های کوآنتومی، توانایی فن آوران برای تغییر اندازه بسته های کوآنتایی مواد است. با اینکه دانشمندان از عناصر جدول مندلیف برای طراحی نیمه رساناهای نانویی[۱۹۷] استفاده می کنند، با تغییر اندازه بسته های کوآنتایی، فن آوران نانو می توانند خواص مواد را هم تغییر دهند.
- نتیجتا در علم، گویی دانشمندان نانو توانسته اند نوعی ابرجدول تناوبی عناصر[۱۹۸] نانو را بسازند که خواص آن عناصر[۱۹۹] فراتر از خواص مواد اتمی نخستین یا مادر می روند. خواص چنین موادی نانویی، پیچیده تر، و طراحی شده و مهندسی شده هستند و هرگز بنحوی طبیعی در عنصر مادر وجود نداشته اند.
در پایان این فصل کتاب و برای نوعی جمع بندی آنچه در این مقاله و این فایل صوتی اشاره کردم اینکه:
۱- بسیاری از خواص موادی[۲۰۰] که ما در ابعاد روزمره مشاهده یا تجربه می کنیم از قبیل سختی، انعطاف، سنگینی، رنگ، و غیره، در واقع از خواصی در مقیاس های نانویی مواد و در برهم کنش با حس های ما پدیدار می شوند[۲۰۱]. چیدمان اتمی آن مواد، مانند نوع پیوند شیمیایی آنها و غیره، همه و همه در مقیاس های نانویی هستند،
۲- اینکه برای مهندسی مواد در دنیای نانو، مفاهیمی از قبیل بسته های کوآنتایی[۲۰۲] الکترون ها، خواص موج ذرّه ای آنها (که تونل زنی کوآنتومی هم نامیده شده،) و توانایی موج های الکترونی برای انتقال انرژی الکتریکی یا برای تراگسیل اطلاعات الکترونیکی[۲۰۳] حائز اهمیتی بسیار هستند،
۳- اینکه فوتون ها در طول موج هایی بلندتر (چند صد نانومتری) هم می توانند موج مانند باشند، اما الکترون ها خاصیت موج مانند و گستره ی فضایی[۲۰۴] خود را تنها در مقیاس های چند نانومتری (که همان تونل زنی کوآنتومی است، و در بخش صنعت الکترونیک و کامپیوتر مطرح می شود ) نمایان می سازند. و بالاخره
۴ – اینکه در موادی با ساختارهایی نانویی، ما با وفور نسبی سطح در مقایسه با حجم[۲۰۵] آنها روبرو هستیم[۲۰۶] و نتیجتا با همان پدیده اندازه پذیری مواد نانویی[۲۰۷].
همه مفاهیمی که بدان اشاره داشتم، ابزارهایی فنی و روش هایی علمی را در اختیار دانشمندان علم نانو می گذارند تا آنها توانایی طراحی و مهندسی مواد در ابعاد نانو را داشته باشند که در فصل های بعدی بدان ها خواهم پرداخت .
وقت و روزگار خوش. دانا و توانا باشید.
پی نوشت د
جدول تناوبی عناصر شیمیایی
———————————–
New product development
با سپاس از دوست گرامی، جناب اسفندیار منفردزاده، که با مهر و دوستی آهنگ آغازین و پایانی “سفر به ریزها” را برای فایل های صوتی من ساختند.
“The Handbook of Nano Technology, Policy and Intellectual Property Law”, John C. Miller, et al, Hoboken New Jersey: John Wiley and Sons, 2005.
چاپ و انتشار این مقالات و فایل های صوتی بدون ذکر نام نویسنده (ر. رخشانی) و مرجع، و هرگونه استفاده برای مقاصد خصوصی و اهداف انتفاعی بدون گرفتن مجوز از نویسنده اکیدا غیر قانونی است.
برای مقالات علمی من (منجمله این مقاله) به شکل پی دی اف، لطفا به کانال تلگرام “سرشت علم” من مراجعه فرمائید
https://t.me/natureofscience
Sattler, Klaus, D. 21st Century Nanoscience – A Handbook: Industrial Applications. CRC Press, 2020.
Sanders, Wesley, C. Basic Principles of Nanotechnology. CRC Press, 2018.
Nanoworld Building Blocks
Taylor, Mark C. The Moment of Complexity. Chicago, The University of Chicago Press, 2001.
Sanders, Wesley, C. Basic Principles of Nanotechnology. CRC Press, 2018.
Building blocks
Frankel, Felice, C. and Whitesides, George, M. No Small Matter: Science on the Nanoscale. Belknap Press of Harvard University, 2009.
Callister, William, D. and Rethwisch, David, G. Materials Science and Engineering. John Wiley & Sons, 2010.
لطفا به مقالات و فایل های صوتی ۱۵، ۱۶، ۱۷ و ۲۴ “سرشت علم” من در تلگرام رجوع و گوش کنید.
https://t.me/natureofscience
Particle physics
Sattler, Klaus, D. 21st Century Nanoscience – A Handbook: Industrial Applications. CRC Press, 2020.
Green, Dan. Physics: Why Matter Matters!, Kingfisher, 2008.
Hornyak, Gabor, L. and Dutta, Joydeep, and Tibbals, H. F. Introduction to Nanoscience. CRC Press, 2008.
Mendeleev periodic table of elements
لطفا به مقاله و فایل صوتی ۲۰ “سرشت علم” من در تلگرام رجوع و گوش کنید.
https://t.me/natureofscience
Common chemical properties
Sargent, Ted. Dance of the Molecules: How Nanotechnology is Changing Our Lives. Avalon, New York, 2006.
Natelson, Douglas. Nanostructures and Nanotechnology. Cambridge University Press, 2015.
Niels Bohr
Huang, Wen, and Shao, Song, and Ye, Xiangdong. Nil Bohr – Sets and Almost Automorphy of Higher Order (memoirs of the American Mathematical Society.) American Mathematical Society Publication, 2016.
Ground state
Excited state
An electron jumping from one orbit to a lower energy orbit
Kragh, Helge. Niels Bohr and the Quantum Atom: The Bohr Model of Atomic Structure 1913-1925. Oxford University Press, 2012.
Electromagnetic potential energy
Light-matter interactions
Einstein, Rutherford and Planck
Discrete packets called Quanta
Heilbron, J. L. Rutherford-Bohr Atom: American Journal of Physics, Volume 49, 1981.
Quantum jump
Trefil, J.S. and Hazen, R.M. The Sciences, An Integrated Approach, 2nd Edition. Chapter 7. New York: Wiley, 1997.
Tong, Xin, and Wang, Zhiming. Core/ Shell Quantum Dots: Synthesis, Properties and Devices. Springer, 2020.
Photon
Gordin, Michael, D. A Well-Ordered Thing: Dmitrii Mendeleev and the Shadow of the Periodic Table. Princeton University Press, 2018.
لطفا به مقاله و فایل صوتی ۲ “سرشت علم” من در مورد روش علمی در تلگرام رجوع و گوش کنید.
https://t.me/natureofscience
Synthesis as the 2nd step in Scientific Method cycle
Anomalies
Synthesis is the second step in the Scientific Method cycle, followed by Hypothesis and Prediction as 3rd and 4th steps respectively
Van Spronsen, J.W. The Periodic System of Chemical Elements. New York: Elsevier, 1969.
Flame spectroscopy
Inert gases
Fluorine isolation
Henri Moissan
Banks, Ronald, E. Fluorine: The First 100 years / 1886-1986. Elsevier, 1986.
Marie and Pierre Curie
Birch, Beverly, and Birmingham, Christian. Marie Curie’s Search for Radium. B. E. S. Publisher, 1996.
Pflaum, R. Grand Obsession: Madame Curie and Her World. New York: Doubleday, 1989.
Atomic weight
Rutherford, Ernest. Radioactive Transformations (Classic Reprint.) Forgotten Books, 2016.
Atomic number
Ions
Strathern, Paul. Mendeleyev’s Dream: The Quest for the Elements. Pegasus Books, 2019.
Mendeleev, Dmitri Ivanovich, and Jensen, William, B. Mendeleev on the Periodic Law: Selected Writings, 1869 – ۱۹۰۵٫ Dover Publications, 2005.
Similar arrangements of outer electrons
Magic numbers
Kawazoe, Y. and Kondow, T. and Ohno, Kauro. Clusters & Nanomaterials. Springer, 2001.
Bonding
لطفا به مقاله و فایل صوتی ۲۱ “سرشت علم” من در تلگرام رجوع و گوش کنید.
https://t.me/natureofscience
Lindsay, Stuart. Introduction to Nanoscience. Oxford University Press, 2009.
Sattler, Klaus, D. 21st Century Nanoscience – A Handbook: Design Strategies for Synthesis and Fabrication. CRC Press, 2019.
Sattler, Klaus, D. 21st Century Nanoscience – A Handbook: Exotic Nanostructures and Quantum Systems. CRC Press, 2020.
State of lowest energy
Boulders
Gravitational potential energy
Inert gases
Kitten, Primrose. Atoms, Electrons, Structure and Bonding: The Workbook. Independently Published, 2017.
Release of energy
Manyanga, Dr. Fidelis, and Sithole, Dr. Alec. Quantum Mechanical Model of the Atom, Electron Configurations and Chemical Periodicity. CreateSpace Independent Publishing Platform, 2014.
Stewart, Angus. IBDP SL Chemistry (chemical Bonding and Structure): Topic 4 . Amazon.com LLC, 2020.
Ionic bonding, metallic bonding, and covalent bonding
The most unstable
Violent
Charged ions
Alkali metals
Halogens
Quartz
Corundum or Al۲O۳ in ruby and sapphire
Coulomb’s Law
لطفا به مقاله و فایل صوتی شماره ۹ “سرشت علم” من در تلگرام رجوع و گوش کنید.
https://t.me/natureofscience
Hard but brittle
Insulators
Metallic bonds
Winter, Mark, J. Chemical Bonding. Oxford University Press, 2016.
Unbounded electrons
Positively charged islands
Hoch, Constantin. Compounds with Polar Metallic Bonding. MDPI AG, 2019.
Less than half full
Brass
Copper
Zinc
Bronze
Tin
Pewter
Antimony
Lead
Alloy
Dill, Ken, A. and Bromberg, Sarina. Molecular Driving Forces: Statistical Thermodynamics in Biology, Chemistry, Physics, and Nanoscience, 2nd Edition. Garland Science, 2010.
Hoffmann, R. The Same and Not the Same. New York: Columbia University Press, 1995.
Malleability
Fisher, David. Bonding by Self-Propagating Reaction. Materials Research Foundation, 2019.
Conductor
Covalent bonds
Frenking, Gernot. The Chemical Bond. Wiley – VCH, 2014.
Versatile
Douglas, Kenneth. DNA Nanoscience: From Prebiotic Origins to Emerging Nanotechnology. CRC Press, 2017.
Jain, Kewal, K. The Handbook of Nanomedicine. Humana Press, 2017.
Alivisatos, A. Paul. Less is More in Medicine. Scientific American 17, 2007.
Cui, Zheng. Nanofabrication: Principles, Capabilities and Limits. Springer, 2017.
Buckyballs and buckytubes
House, James, E. Inorganic Chemistry. Academic Press, 2012.
Mallouk, Thomas, E. and Sen, Ayusman. How to Build Nanotech Motors. Scientific American, 300, no. 5 (May 6, 2009.)
Management of interface
Sabari Arul, Narayanasamy, and Nithya, Vellalapalayam Devaraj. Revolution of Perovskite: Sysnthesis, Properties and Applications. Springer, 2020.
Robinson, A. L. Electron Microscope Inventors Share Nobel Physics Prize. Science 234, 1986.
Sinha, Shweta. Exploring Heat Light Sound Energy. The Energy and Research Institute, TERI. 2016.
Witte, Robert, A. Spectrum and Network Measurements. SciTech Publishing, 2014.
Monochromatic
Branley, Franklyn Mansfield, and Dank, Leonard. The Electromagnetic Spectrum: Key to the Universe. Ty Crowell Company, 1980.
Dill, Ken, A. and Bromberg, Sarina. Molecular Driving Forces: Statistical Thermodynamics in Biology, Chemistry, Physics, and Nanoscience, 2nd Edition. Garland Science, 2010.
Kolsrud, Arild. The Electromagnetic Frequency Spectrum of North America: Desk Reference for What Can be Found on the Airways. Independently Published, 2019.
Infrared
Infrared or thermal signature
With precision
Finer spatial resolution
Ultraviolet light
X rays
Nanotechnology and photoelectric effect
Cornelius, David William. The Study of the Velocity of Electrons in the Photo-Electric Effect, as a Function of the Wave-Lengths of the Light. Franklin Classics, 2019.
Raza, Hassan. Nanoelectronics Fundamentals: Materials, Devices and Systems (Nanoscience and Technology.) Springer, 2019.
Ran, Fen, and Chen, Shaowei. Advanced Nanomaterials for Electrochemical Energy Conversion and Storage. Elsevier, 2019.
Raza, Hassan. Nanoelectronics Fundamentals: Materials, Devices and Systems (Nanoscience and Technology.) Springer, 2019.
Emissions of electrons
لطفا به مقاله و فایل صوتی شماره ۲۸ “سرشت علم” من در تلگرام رجوع و گوش کنید.
https://t.me/natureofscience
Stone, Douglas, A. Einstein and the Quantum: The Quest of the Valiant Swabian. Princeton University Press, 2015.
Threshold energy level
Seeman, Nadrian, C. Structural DNA Nanotechnology. Cambridge University Press, 2016.
Atkins, Peter, and de Paula, Julio, and Friedman, Ron. Quanta, Matter and Change: A Molecular Approach to Physical Chemistry. W. H. Freeman, 2008.
Maggiore, Michele. Gravitational Waves: Volume 1: Theory and Experiments. Oxford University Press, 2007.
Thermal imaging
Thayalan, K. The Physics of Radiology and Imaging. Jaypee Brothers Medical Publishers, 2016.
Ahmad, Shamim, I. Ultraviolet Light in Human Health, Diseases and Environment. Springer, 2017.
Vollath, Dieter. Nanomaterials: An Introduction to Sysntrhesis, properties and applications. Wiley – VCH, 2013.
Trimbakrao, Suresh. Nanomaterial Synthesis, Characterization and its Applications: A Scientific Approach. LAP Lambert Academic Publishing, 2019.
Scheer, Elke, et al. Molecular Electronics: An Introduction to Theory and Experiment (World Scientific Series in Nanoscience and Nanotechnology.) WSPC, 2017.
Stained glass
Klabunde, Kenneth, J. and Richards, Ryan, M. Nanoscale Materials in Chemistry. Wiley, 2009.
Plasmonics
Jacak, Witold, A. Quantum Nano-Plasmonics. Cambridge University Press, 2020.
Hentschel, Klaus, and Hentschel, Ann, M. Photons: The History and Models of Light Quanta. Springer, 2018.
Ordinary properties of materials
Manifestations
Graphite
Wang, Aiqin, and Wang, Wenbo. Nanomaterials from Clay Minerals: A New approach to Green Functional Materials. Elsevier, 2019.
Layered
Can slide horizontally
Cao, Guozhong, and Wang, Ying (Jane.) Nanostructures and Nanomaterials: Synthesis, Properties and Applications. World Scientific Publishing Company, 2010.
Graphene
Bucky balls
Bucky tubes
Torres, Luis, E. F. and Roche, Stephen, and Charlier, Jean-Christophe. Introduction to Graphene-based Nanomaterials: From Electronic Structure to Quantum Transport. Cambridge University Press, 2020.
Optical and electrical properties
Voigtlaender, Bert. Atomic Force Microscopy (Nanoscience and Technology.) Springer, 2019.
Paul, Harry, and Jex, Igor. Introduction to Quantum Optics: From Light Quanta to Quantum Teleportation. Cambridge University Press, 2004.
Nanostructured materials
Quantum effects
Wang, Xiaodong, and Wang, Zhiming, M. Nanoscale Thermoelectrics. Springer, 2013.
New designer properties
Quantum dots
Efros, Alexander, L. and Lockwood, D. J. and Tsybeskov, Leonid. Semiconductor Nanocrystals: From Basic Principles to Applications. Springer, 2013.
Harrison, Paul, and Valavanis, Alex. Quantum Wells, Wires and Dots: Theoretical and Computational Physics of Semiconductor Nanostructures. Wiley, 2016.
Wave-particle duality, in Wavicles
Vibrations
Spatial extent
Same chemical composition
Emitting different colors
Different varying particle size
Electron wave
Discrete energy packs called Quanta
Higher energy level
Ezawa, Zyun Francis. Quantum Hall Effects: Recent Theoretical and Experimental Developments. WSPC, 2013.
Mukhanov, Viatcheslav, and Winitzki, Sergei. Introduction to Quantum Effects in Gravity. Cambridge University Press, 2007.
Tunable semiconductors
Unavoidable wavelike nature
Specific quantum property
Scheer, Elke, et al. Molecular Electronics: An Introduction to Theory and Experiment (World Scientific Series in Nanoscience and Nanotechnology.) WSPC, 2017.
Quantum tunneling
Haar, Ter, D. Problems in Quantum Mechanics: Third Edition. Dover Publications, 2014.
Waves and particles into wavicles
Electrons’ wave-particle dual nature
A few nanometer length scale
Jacak, Witold, A. Quantum Nano-Plasmonics. Cambridge University Press, 2020.
Nanoscale semiconductor design
Periodic super table of nano-elements
Properties of elements
Properties of materials
لطفا به مقاله و فایل صوتی شماره ۵۶ “سرشت علم” من در کانال تلگرام رجوع و گوش کنید.
https://t.me/natureofscience
Quanta
Electronic information transfer
Spatial extent
Kolasinski, Kurt, W. Surface Science: Foundations of Catalysis and Nanoscience. Wiley, 2020.
Kattan, Peter, I. Ratio of Surface Area to Volume in Nanotechnology and Nanoscience (Basic Nanomechanics Series.) Petra Books, 2011.
Commensurability of nanomaterials
فصل اول سفر به ریزها؛ آشنایی سیستمی با علم و فن آوری نانو


 به کانال تلگرام سایت ملیون ایران بپیوندید
به کانال تلگرام سایت ملیون ایران بپیوندید