دکتر ریموند رخشانی *
مقاله و فایل صوتی بیست و دوم:
نقش کربن در شیمی[۱]
اساسِ پیوَندهایِ شیمیایی گرایشِ اتم ها به ثُبات است تا در مَدارهایِ بیرونی خود ۲، ۱۰، ۱۸، ۳۶، ۵۴ و یا ۸۶ الکترون داشته باشند[۲]. با اینکه تنها سه نوع پیوندِ شیمیایی بیشتر مُوجود نیست و تنها معدودی از عناصر بیشتر نداریم شاید به اندازه ای بی نهایت ترکیباتِ شیمیایی را از همین مجموعه می توان تشکیل داد.[۳]
عنصرِ کربن به دلیلِ توانایی بی نظیرِ خود در شکل دهی به پیوندهایِ کووالانسی و در بوجودآوردنِ ترکیباتِ شیمیایی نقشی عمده دارد. شاید بیش از ۹۰%ترکیباتِ شیمیایی[۴] در خود کربن دارند و رشته یِ تخصصیِ شیمی ارگانیک موضوعِ پژوهشِ همین ترکیباتِ کربنی است.
شکل های هندسیِ ترکیباتِ کربنی عمدتاً بدلیل نیاز عنصرِ شماره ی ۶جدول، کربن، برای جذبِ ۴ الکترونِ است تا مدارِ بیرونی اتم خود را کامل کند.
شاید نگاهی به ترکیباتِ کربن و هیدروژن در این زمینه گویا باشد.
- ساده ترین ترکیبِ هیدروکربن گازِ متان[۵] CH۴ است که ۴ اتمِ هیدروژن (در پیوندی کووالانسی) در اطرافِ اتم کربن قرار دارند.
- دلیلِ بنیادینِ گوناگونی در شیمی ارگانیک این است که اتمِ کربن به سادگی با اتم خود پیوند می زند و دیگر اینکه پیوندِ C-C می تواند پیوندِ C-H را جایگزین شود. برای نمونه در گاز مِتان با جایگزین کردن یکی از پیوندهای C-H با پیوندِ C-C گازِ اِحتراقی اِتان با فرمولِ C۲H۶ داریم. اگر دو پیوند را جایگزین کنیم، گازِ پروپان C۳H۸ بدست می آید[۶].
- در الماس هر کربنی (تحتِ فشار) در پیوند با چهار کربنِ دیگر در چارچوبی سه بعدی[۷] قرار دارد و آنچه الماس را الماس کرده است، فشار است وگرنه ذغالی بیش نیست.
- آلکان هایِ معمولی[۸] مجموعه ی بزرگی از ترکیباتی با پیوند کووالانسی هستند که ستونِ اصلی آنها پیوندهایِ کربنی از نوعِ C-C-C-C-… است که با اتم هایِ هیدروژن در پیوند هستند.
- بوتان با فرمولِ C۴H۱۰ و پروپان C۳H۸، نمونه هایی از آلکان ها هستند.
هیدروکربنها[۹] می توانند ساختار شاخه ای نیز داشته باشند.
- ساده ترین ساختِ شاخه ای هیدروکربن که چیدمانِ چهار کربنی ای شبیه به حرف T لاتین دارد ایزوبوتان است. بوتان و ایزوبوتان ایزومِرهای[۱۰] C۴H۱۰ هستند.
- با افزایش یک به یک اتم های کربن در هر ساختار شاخه ای تعدادِ ایزومرها به شکلِ توانی (قوه ای) افزایش می یابد[۱۱]. آلکان هایی با ۲۰ اتمِ کربن یا بیشتر چندین هزار ایزومِر دارند. ایزومرها ترکیباتی شیمیایی شبیه به هیدروکربن ها هستند اما ساختار مولکولی متفاوتی دارند.
- برای نمونه اکتان ۸ کربن اما ۱۸ ایزومر دارد و یکی از آن ایزومرها در رده بندی کردنِ بنزین[۱۲] استفاده می شود.
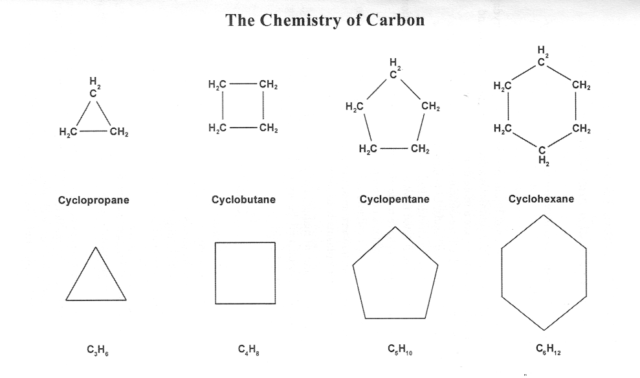
در هیدروکربن های حلقوی یا چرخه ای[۱۳] اتم های کربن تشکیلِ یک یا چند حلقه می دهند.
- یکی از معمولی ترین هیدروکربن هایِ حلقوی، هِکسان حلقوی یا چرخه ای[۱۴] است C۶H۱۲ که ۶ حلقه ی کربنی دارد.
- هیدروکربن های حلقوی هم می توانند ساختار شاخه ای داشته باشند که حلقه های آنها در انواع و اقسام شکل ها بنحو زنجیره ای بهم متصل هستند.
کربن ها همچنین می توانند پیوندِ دوگانه یا دوبل[۱۵] با یکدیگر داشته باشند ( C=C ) که در آن پیوندها دو عدد از چهار الکترونِ بیرونیِ کربن به اشتراک گذاشته شده اند.
- ساده ترین نمونه ی هیدروکربن با پیوندِ دوگانه یا دوبل اِتین است ( C۲H۴ ) که در طبقه بندیِ آلکِن ها قرار دارد[۱۶].
- تمام ساختارهای اشاره شده هم – چه زنجیره ای، چه شاخه ای و چه حلقوی – میتوانند پیوندِ دوگانه یا دوبل داشته باشند. برای نمونه بنزین ( C۶H۶ ) سه پیوندِ تکی ( C-C ) و سه پیوندِ دوگانه ( C=C ) دارد.
کربن ها همچنین می توانند پیوندِ سه گانه[۱۷] با یکدیگر داشته باشند، برای نمونه اسِتیلین (C۲H۲) که در طبقه بندیِ آلکین ها[۱۸] قرار دارد.
کربن ها در همه ی طبقه بندی های اشاره شده، چه در آلکان ها، چه آلکِن ها و چه آلکین ها پیوندهایِ بی نهایت گوناگون دارند.
خصوصیاتِ هیدروکربن ها با ساختار آنها ارتباطی نزدیک دارد.
- همه ی هیدروکربن ها قابلیتِ سوختن دارند و در واکنش با اکسیژن، حرارت و آب و دی اکسید کربن (CO۲) تولید می کنند.
- کوچکترین ملکول های آنها که چهار یا کمتر اتمِ کربن دارند به شکل گاز و یا به شکل مایعی آتش گیر یا قابلِ احتراق[۱۹] هستند منجمله پروپان ( C۳H۸) و بوتان( C۴H۱۰ ) .
- مولکول های بزرگتر با ساختارهای زنجیره ای اغلب جِرمی سنگین تر و بنابراین نقطه ی آتشگیری یا اِحتراق و نقطه ی جوشش و نقطه ی ذوب بالاتری دارند[۲۰].
- هیدروکربن های شاخه ای اغلب نقطه ی ذوب و جوشش پایین تری دارند چرا که مانندِ ساختار زنجیره ای ها بهم گره نخوردهاند.
شیمی ارگانیک یا کربنی با اضافه کردنِ عناصری دیگر به پیوندهای کربنی پیچیده تر می شود.[۲۱]
- اکسیژن که برای پایدار شدن به دو الکترون نیازمند است اغلب با اتمِ کربن پیوندی دوبل می سازد. برای نمونه در دی اکسید کربن (CO۲) هر اکسیژن پیوندی دوبل با اتم کربن دارد و یا در فرمالدوئید (CHOH) اکسیژن با کربن پیوندِ دوبل و هیدروژن با کربن پیوندِ تکی دارد.
- اتم های اکسیژن همچنین می توانند بخشی از پیوندهای حلقوی اتم ها باشند.
گروه هیدروکسیل (OH) با اتمِ کربن پیوند تکی می سازد.
- در این نمونه ساده ترین الکل متانل (CH۳OH) است. اِتانل (C۲H۵OH) هم الکلی است که در آبجو، شراب و دیگر مشروب ها یافت می شود.
- اسید فرمیک (OH)CHO که ساده ترین اسیدهاست نقشی کلیدی در همه ی ارگانیسم های زنده بازی می کند.
عنصر شمارهی ۷، نیتروژن برای ثبات به سه الکترون نیازمند است . بنابراین در تمام ترکیباتِ کربنی، چه در زنجیره ای ها، چه در حلقوی ها و چه در شاخه ای ها نقشی پیچیده دارد.
همه ی ملکول هایِ کربن پایه ای[۲۲] بارِ الکتریکی خنثی دارند. این ملکول ها منطبق با جاذبه یِ فان در والی[۲۳] با یکدیگر پیوند می زنند.
- هنگامیکه دو ملکول به یکدیگر نزدیک می شوند، هر الکترون و پروتون نیرویِ برق ساکنی را از الکترون و پروتون ملکول دیگر تجربه می کند.
- تغییر شکل یا دِفرمه شدن الکترون ها در اثر این نیرو ممکن است به ایجاد نیروی جاذبه ی کوچکی که به جاذبه ی فان در وال معروف است بیانجامد.
- برخی لایه های معدنی منجمله پودرِ بچه و گرافیت (نوکِ مداد) از طریقِ جاذبه ی فان در وال بهم پیوسته اند[۲۴].
پولیمرها منجمله بافت های مصنوعی(همنهشته[۲۵]) از قبیل نایلون، رایون، رنگ ها و چسب ها، اسفنج های عایق بندی یا ایزولاسیون و بسیاری مواد دیگرِ از پراستفاده ترین ملکول های ارگانیک (کربنی) هستند.
- پولیمرها اغلب به شکل مایعی از مونومِرها [۲۶]که ملکول های کوچک کربن پایه اند آغاز می شوند.
- مونومرهای نایلون دو ملکول زنجیره ای ۶ کربنی هستند.
- هنگامیکه این موادِ شیمیایی مخلوط می شوند، بافت های محکم و منعطفی می سازند.
- پلاستیک ها از رشته های بهم پیوسته و پیچیده ی پولیمرها ساخته شده اند.
- سختی و انعطافِ پولیمرها بستگی به چگونگیِ وصل و پیوند ضربدری رشته ها به یکدیگر دارند[۲۷].
- اگر مونومرهای اولیه شاخه ای باشند، نوعِ وصل و پیوند ضربدریِ پولیمرها کووالانسی می شود.
نوعِ دیگر پیوندِ ضربدری در پلاستیک ها پیوندِ هیدروژنی است.
- هرگاه اتم هیدروژنی در خارج از ملکولی ارگانیک قرار گیرد، اغلب بارِ مثبت کوچکی پیدا می کند، در حالیکه بقیه ی اتم ها از قبیل اکسیژن بارِ منفی کوچکی می گیرند.
- پیوندهایِ هیدروژنی از جاذبه یِ بینِ دو بارِ (شارژِ) مثبت و منفی شکل می گیرند.
- پیوندهایِ هیدروژنی منفرد اغلب بسیار ضعیف اند اما چنانچه تعداد زیادی از این پیوند بین مولکول های یک جسم قرار داشته باشد، مانند آنچه در پلاستیک دیده می شود، سبب استحکام و سختی[۲۸] آن جسم خواهد بود.
- دلیلِ سختیِ یخ (آبِ منجمد) هم همین توان یا قدرتِ (چند ملکولیِ) تعداد زیاد پیوندهایِ هیدروژنی در آن است.
در اینجا لازم می بینم تا به وضعیت هایِ ماده در دنیای طبیعی و به تغییرِ فازهای آن بپردازم.
وضعیتهایِ ماده و تغییرِ فازها (وضعیتِ مادهها)
اتم ها در گوناگونی هایِ خود خواص یا خُصوصیاتِ فیزیکی و شیمیایی متفاوت دارند. عَملکردِ کره ی زمین و براستی وجودِ زندگی بر این کره متکی بر هَمزیستیِ وضعیت هایِ مختلفِ ماده ها هستند. وضعیت های (فازها و حالت ها) مواد – چه جامد، چه مایع ، چه گاز و چه پلاسما – مظاهر و صورت های خارجیِ ساخت هایِ کوچکتر یا زیر میکروسکوپیِ اتم ها و ملکول ها هستند.[۲۹]
اجسامِ جامد اغلب کم و بیش شکلی ثابت دارند که در نتیجه ی چیدمانِ سه بعدیِ پیوندهایی نسبتا محکم و سویه دار[۳۰] آنها است.
- در کریستال ها، اتم ها طرح هایِ منظم و تکراری دارند. برای نمونه در نمک، طرحِ مکعبی ای (تقریبا یک میلیاردم سانتی متر) از اتم هایِ کلر و سدیم تکرار می شود. بسیاری موادِ معمولی از قبیل جواهرات، شن های ساحلی و چیپ های کامپیوتری به شکلِ کریستال هستند. بیشترِ فلزات، سنگ ها، بتون و سفال ها چند کریستالی[۳۱] و تشکیل شده از کریستال هایِ درهم پیچیده هستند.
- شیشه نامی عام برای جامدی است که ساختِ کریستالی ای منظم ندارد. در بیشترِ شیشه ها محیطِ اتمی[۳۲] قابل پیش بینی است اما چیدمانِ اتم های همجوار منظم نیست.
- پلاستیک جامدی است که از پولیمرها شکل گرفته است. نتیجتاً پلاستیک ها ساختی قابلِ پیش بینی و سویه دار (در راستای هر زنجیر پولیمر) و چیدمانی کمتر منظم بینِ زنجیره های درهم پیچیده[۳۳] دارند.
- موادِ مرکب[۳۴] (یا آمیزه ای) منجمله تخته چندلا، بتون آرمه و یا استخوان، دو یا چند کریستال، شیشه و یا پولیمر را در هم می آمیزند و خصوصیاتِ مادی آنها از خواص یا خصوصیاتِ تک به تکِ ماده هایِ تشکیل دهنده شان بیشتر است.
مایعات مجموعه ای از اتم ها و ملکول ها هستند که شکلی ثابت ندارند و در حینِ پایستگی یا حفظِ حجم خود می توانند شکل عوض کنند.
- در ابعادِ ملکولی کارکردِ مایعات را می توان به کیسه ای از آرد یا شکر تشبیه کرد. نیروها ذرّات را بهم نگه میدارند اما آنها آزاد هستند تا از پهلوی یکدیگر حرکت کنند. در مایعات، نیرویِ بینِ ملکول ها منجر به تنش یا کشش سطحی[۳۵] می شود که بنوبه ی خود امکانِ تغییرِ شکل را در مایعات بوجود می آورد. آب فراوان ترین نوعِ مایعات در طبیعت است و نقشی کلیدی در حیات بر روی کره ی زمین بازی می کند.
- کریستال مایع ها[۳۶] متشکل از ملکول هایِ قطب دار هستند که در میدان یا حوزه ای الکتریکی قطبی با بارِ منفی ای کم و قطبی دیگر با بارِ مثبتِ کوچکی دارند . هنگامیکه آن میدان الکتریکی خاموش است، آنها مانندِ مایعاتِ معمولی عملکرد دارند که در آنها ملکول ها سویه های دلبخواهی[۳۷] دارند. اما وقتی که میدان یا حوزه ی الکتریکی روشن است تمامِ ملکولها مانندِ سوزنِ قطب نما هم راستا میشوند . چنین پدیده ای شکلِ مایع را تغییر می دهد. کریستال مایع ها در ساختِ ساعت هایِ دیجیتال یا صفحه یِ مانیتورها استفاده می شوند.
گازها مجموعه ای از اتم ها و ملکول هایی هستند که به حجمِ ظروفِ خود منبسط می شوند.
- گازهای خنثی ترکیباتی تک اتمی هستند. گازهای دیگر (از قبیل O۲, CO۲, NH۳ ) از ملکول هایِ کوچک تشکیل شده اند. فشارِ گاز در نتیجه ی برخوردِ ذراتِ گاز با ظرف خود ایجاد می شود.
- وقتیکه گازی تا دمایی بالا حرارت داده شود، برخورد مولکول ها با چنان شدتی صورت می پذیرد که برخی الکترون ها از اتم ها و ملکول هایِ خود جداشده آنها تبدیل به یون می شوند. چنین وضعیتِ جدیدی پلاسما نامیده می شود که وافرترین وضعیتِ موجودِ ماده در گیتی[۳۸] است. فاز پلاسما شکل دهنده ی همه ی ستارگان در گیتی است.
- لامپ هایِ مهتابی (فلورسنت) هم بر اساسِ چنین عملکردِ پلاسمایی کار می کنند.
ماده می تواند بین جامد، مایع و گاز تغییرِ وضعیت[۳۹] (فاز) دهد. این تبدیل و تغییرهای انجماد، تبخیر، ذوب، جوشش و تراکم[۴۰] اغلب از طریقِ تغییرِ درجه ی حرارت صورت می پذیرند.[۴۱]
- برای نمونه آب در درجه ی حرارتِ معمولی به شکلِ مایع است و در یخدان به جامد تبدیل شده و در حرارتِ بالا به گاز (بخار) تغییر می کند. آب مانندِ بسیاری مواد دیگر در حرارت هایِ هزاران درجه به پلاسما تغییر شکل می دهد.
- نمونه ی شمع هم برای نشان دادنِ تبدیلِ وضعیت ها (فازها) گویاست. شمع در حرارتِ معمولی جامد است اما در حرارتِ بالاتر و زیر ۱۰۰ درجه ی سانتیگراد آب شده به شکلِ مایع است. در حرارتهای بالاتر شمع بصورتِ شعله ی روشنی سوخته و تبدیل به گاز می شود.
- این تغییر و تبدیل ها بدلیلِ تغییرِ آهنگِ ارتعاشاتِ ملکولی[۴۲] در مواد در حرارت های متفاوت اند. گرمایِ معتدلِ کره ی زمین آب را بصورتِ مایع نگه داشته که برای بقایِ حیات کلیدی است.
- پالایش فرآیندی است که با استفاده از حرارت ملکول هایِ متفاوت را از نفت خام جدا می کند. برج هایِ تقطیر[۴۳] در پالایشگاه ها امکانِ استخراج گازهایی چون پروپان، گازِ طبیعی، بوتان و حتی آسفالت از نفتِ خام را فراهم می کنند.
تغییرِ و تبدیل وضعیتِ (فاز) مواد از طریقِ فشار هم صورت می پذیرد.
- فشار را می توان به وارد کردن نیرویی بر هر سطحی تعریف کرد. برای مثال میخ کوبیدن یا دگمه فشاردادن نمونه های فشار هستند.
- فشارِ (رو به افزایشِ در عمق) یکنواختی را که برایِ مثال غواص ها تجربه می کنند فشارِ ئیدرواستاتیک[۴۴] می نامند. آتمسفر یا جو چنین فشاری را، که معادل با ۱۴.۷ پوند بر هر اینچِ مربع در سطحِ دریاست، داراست. فشارهایی پایین تر از این مقدار را خلا جزیی[۴۵] می نامند.
- در فشارهایِ پایین تر آب در درجاتِ پایین تری بجوش می آید.
- در فشاری حدودا ۱۰۰۰۰ آتمسفر آب در درجه ی حرارتی معمولی منجمد میشود. آنچنان یخِ انبوه و غلیظِ حاصله در آنچنان فشاری بالا از یخِ معمولی ای که ما در نوشابه های مان استفاده می کنیم متفاوت است.
- دانشمندانِ حوزه ی علم فشارهایِ بالا را با استفاده از ابزاری که ” سلولِ الماس سندانی[۴۶]” نامیده می شود مطالعه می کنند. نمونه هایِ آزمایشی بین دو نوکِ الماسیِ آن ابزار قرار گرفته و فشارداده می شوند.
- اختراعِ سلول هایِ الماس سندانی شرایط آزمایش فشارهایی تا میلیون ها برابرِ آتمسفر (بالاتر از فشارِ هسته یا مغزه یا مرکزِ کره ی زمین) را فراهم کرده است.
- هر ماده ای در فشارهایِ بسیار بالا جامد می شود.
دگرگونه گی هایِ حالاتِ (فازها یا وضعیت هایِ) ماده ها در اثرِ حرارت یا در اثرِ فشار اغلب بوسیله ی “فاز نمودار” (یا نمودار فازی[۴۷]) نشان داده می شود . اینچنین نمودارهایی فازهایِ تبدیل وضعیتِ مواد را در فشار و حرارت های متفاوت ترسیم می کنند. برای نمونه در ” نمودار فازی ” آب میتوان دید که در دمایِ ۳۷۴ درجهی سانتیگراد و فشارِ ۲۲۰ آتمسفر، آب می تواند به نحوی همزمان مایع، جامد و بخار باشد.
شگفت انگیزترین اثرِ فشار و حرارت های بسیار بالا تغییرِ فازهایی است که ماده ای جامد را به جامدی دیگر تبدیل می کند.[۴۸]
————————————
Rakhshani, Raymond. Origins of Modernity. Even Development in the Evolution of Science and Technology. South Carolina: CreateSpace, A Division of Amazon Publishing, 2011.
Zaikov, G.E. and Pourhashemi, A. Chemical and Biochemical Engineering: New Materials and Developed Components. Apple Academic press, 2017.
Snyder, C.H. The Extraordinary Chemistry of Ordinary Things. New York: Wiley, 1992.
chemical compounds
methane
Ethane and propane
three-dimensional framework
normal alkanes
hydrocarbons
isomers
exponential
rating
cyclic hydrocarbons with rings
cyclohexane
double-bonded
ethene in alkene series
triple-bonded
alkyne series
combustible
Combustion, boiling point, and melting point
Trefil, J.S. and Hazen, R.M. The Sciences, An Integrated Approach, 2nd Edition. New York: Wiley, 1997.
carbon-based
در فارسی Van der Waal ، وان در وال ترجمه شده اما در واژه های ژرمانی حرف V به صورت ف تلفظ می شود.
talc and graphite
synthetic fibers
monomers
Cross-linking of strands
hardness
Hazen, R.M. The New Alchemists: Breaking the Barriers of High-Pressure Research. New York: Times Books, 1993.
directional
polycrystalline
atomic environment
intertwined chains
composite materials
surface tension
liquid crystals
random directions
The universe
transform
condensing
Trefil, J.S. and Hazen, R.M. The Sciences, An Integrated Approach, 2nd Edition. Chapter 9. New York: Wiley, 1997.
changing rates of molecular vibrations
distillation towers
Hydrostatic pressure
partial vacuum
diamond anvil cell
phase diagram
Hoffman, R. The Same and Not the Same. New York: Columbia University Press, 1995.
————————————————————–
—————–
* دکتر ریموند رخشانی در باره خودش:
من ریموند رخشانی هستم و حوزه کارشناسی من مهندسی سیستمها است، و تخصص من در بکارگیری اندیشه سیستمی برای انتقال فن آوری و اجرا و پیاده سازی تولید فراوردههای نوین میباشد. در این سلسله از مقالات و فایلهای صوتی کوشش میکنم که علم مدرن را از پایه به دوستان معرفی کنم.

 به کانال تلگرام سایت ملیون ایران بپیوندید
به کانال تلگرام سایت ملیون ایران بپیوندید